بازدید امروز :6
بازدید دیروز :10
کل بازدید :97996
تعداد کل یاداشته ها : 76
04/5/6
4:57 ع

فیزیک ذرات بنیادی به مطالعه ذرات اصلی و تشکیل دهنده مواد و نیروهای ما بین آنها می پردازد. هدف از این علم ، درک قوانین بنیادی حاکم بر تشکیل مواد و جهان مادی است. همچنین این علم یکی از شاخه های اصلی مطالعات علمی بر سر فهم سر چشمه دنیاست.

این مقاله پایه های فیزیک ذرات را توصیف می کند. لذا می توان با موضوع این بحث آشنا و در هیجان آن با متخصصان شریک شد. این متن تا حد ممکن توصیفی است ، ولی چنانچه اطلاع کمی از فیزیک عمومی داشته باشید ، این مبحث می تواند برای شما مفید باشد.
فیزیک ذرات ، موضوعی جدید است و همه کشف های جدید مربوط به آن ، از آغاز قرن بیستم به بعد انجام شده است. لحظه به لحظه کشف های هیجان انگیزی انجام و گزارش شده است و موجب بازنویسی فصل های مشخصی از این علم شده است ، البته اگر باعث بوجود آمدن سئوال های جدیدی نشود! به همین دلیل ، تنها واقعیت هایی که فکر می کنیم "بطور کامل" پایه ریزی شده اند در اینجا مطرح می شوند.
اتم ها
ممکن است از دروس شیمی پایه آموخته باشید که مواد ، از ذرات بنیادینی بنام اتم تشکیل شده اند. امروزه همه ما می دانیم که تمام مواد تقریبا از ترکیب بیش از 100 گونه اتم های مختلف تشکیل شده اند که آنها را عنصر می نامیم.
به هر حال ، از اوایل قرن بیستم می دانیم که هر اتم حتی از ذرات بنیادی تری به نام پروتون ، نوترون و الکترون تشکیل شده است. هر عنصر به طور منحصر به فردی توسط تعداد پروتون های هسته اتمی خود شناسایی می شود. مطالعه علم شیمی تنها با شیوه و چگونگی بر هم کنش الکترون ها با یکدیگر و تشکیل مواد حاصل از این برهم کنش ها ، سر و کار دارد ، (نیروها یا پیوندهای شیمی). کوچکترین مقیاسی که علم شیمی بدان توجه دارد ، در حد اتم ، است در صورتیکه فیزیک ذرات بنیادی اساسا با هر ذره بنیادی تر از اتم که مواد پایدار را تشکیل می دهند و می توانیم آنها را ببینیم و همچنین موادی که در انرژی های بالا و یا در پیدایش جهان اولیه وجود داشته اند ، سر و کار دارد. این علم همچنین به مطالعه نیروهای حاکم بر این مواد می پردازد. در حقیقت نیروهای شیمیایی ، تنها یکی از انواع خاص نیروهاست که علم شیمی بدان می پردازد.
بسیاری از این ذرات (یا ریز ذرات) از دید علم شیمی و تجربه روزمره ما پنهانند. شیوه ها و وسایل مخصوصی جهت کشف و یافتن این گونه ذرات باید بکار رود. یکی از ابزارهای اصلی ، شتاب دهنده ذرات است. این وسیله ، ماشین غول پیکری است که آثار و محصولات حاصل از برخورد میان این ذرات پر سرعت را آشکار سازی می کند. برای اینکه این ذرات انرژی کافی داشته باشند تا ساختار درونی خویش را آشکار کنند ، باید قبل از برخورد سرعت بسیار بالایی بگیرند. برخی از این ریز ذرات ممکن است تنها مدت بسیار کوتاهی پیش از نابودی و یا تبدیل شدن به ذره دیگر ، به وجود آیند. بنابراین شتاب دهنده های ذرات می توانند برای شبیه سازی جهان هستی در مراحل اولیه تشکیل ، استفاده شوند.
ایزوتوپ ها
پژوهش های تجربی در زمینه فیزیک هسته ای ، به تدریج نیاز به ابزارها و دستگاه های تخصصی پیدا کردند. یکی از اولین دستگاه ها ، طیف نگار جرمی بود که بوسیله فرانسیس استون ، برای اندازه گیری جرم نسبی اتم های یک عنصر ابداع شد. چنانچه یک یا چند الکترون با بار منفی ، از اتمی جدا شوند ، آن اتم باری مثبت پیدا می کند که به آن "یون" اطلاق می شود. (کلمه ای یونانی که به معنی مسافر است).
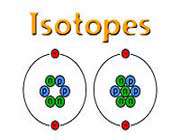
طیف نگار جرمی یون های مثبت یک گاز منزوی (باردار شده) را به سمت صفحه عکاسی هدایت می کند. یون ها توسط میدان های الکتریکی و مغناطیسی عمود بر مسیر منحرف می شوند لذا همه ذراتی که جرم یکسانی دارند بر روی یک خط ظریف متمرکز می شوند. یون های سنگین که لختی بیشتری دارند ، نسبت به یون های سبکتر کمتر منحرف می شوند. با استفاده از طیف نگار جرمی این حقیقت مهم کشف شد که برخی از عناصر شیمیایی شامل دو یا چند جزء هستند که جرم متفاوتی دارند. کلر طبیعی که وزن اتمی آن اعشاری است (تقریبا 35.5) ، مطابق جرم هایش که به 35 و 37 نزدیک هستند ، دو خط بر روی صفحه عکاسی بوجود می آورد ، که البته هیچ یک از ذراتش (در نتیجه آزمایش) اعشاری نبودند. اجزای یک عنصر شیمیایی که اعداد جرمی متفاوتی دارند ، ایزوتوپ خوانده می شوند. بسیاری از عناصر در حالت طبیعی خود شامل دو یا چند ایزوتوپ هستند ، اگرچه 20 گونه از این عنصرها نیز تنها یک نوع ایزوتوپ دارند ، آلومینیم ، کبالت و طلا از آن جمله اند.
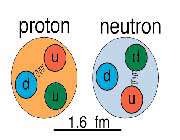
با اصلاح فرضیه برو ، آستون قاعده عدد کامل خود را ارئه داد که بیانگر این مطلب بود که همه جرم های اتمی نزدیک به اعداد صحیح هستند و وزن های اتمی اعشاری عناصر ، ناشی از وجود دو یا چند ایزوتوپ هستند که هر کدام مقدار تقریبی صحیحی دارند. بر اساس مقیاس رایج "کربن -12" امروزی که جرم اتمی "کربن -12" دقیقا 12 واحد است ، دیگر ایزوتوپ ها ، جرم اتمی نزدیک به اعداد صحیح را دارا می باشند. با حل مسئله اعشاری بودن اوزان اتمی ، فیزیکدانان ابتدا بر این باور شدند ، که هسته شامل تعدادی الکترون و پروتون است. هسته ای با عدد اتمی Z و جرم اتمی A ، شامل A پروتون برا لحاظ کردن جرم کل و A منهای Z الکترون برای تعادل بار مثبت پروتون ها در نظر گرفته می شد. این نظریه درباره ساختار هسته ، در سال 1311 هخ (1932 م) توسط جیمز چادویک با کشف نوترون تغییر یافت. این ذره جدید هیچ بار الکتریکی ندارد و جرمی تقریبا برابر با جرم پروتون دارد. امروزه معتقدند که اتم های خنثی حاوی N نوترون ، Z پروتون و Z الکترون گردان هستند به طوری که A=N+Z ، در این صورت ، ایزوتوپ ها نوکلوییدهایی با Z های برابر و N های متفاوت هستند. برای مثال ، هیدروژن طبیعی تقریبا بطور کامل از اتم هایی تشکیل یافته است که حاوی یک پروتون و یک الکترون می باشد. ولیکن مقدار بسیار کمی (در حدود 0.015 درصد) دوتریم (هیدروژن سنگین) در طبیعت یافت می شود. دوتریم شامل یک پروتون ، یک نوترون و یک الکترون است. بطور کلی وضع در مورد عناصر سنگین تر بسیار پیچیده تر می شود. قلع طبیعی که عدد اتمی آن 50 است ، شامل 10 گونه ایزوتوپ با چرم 112 ، 114 ، 115 ، 116 ، 117 ، 118 ، 119 ، 120 ، 122 ، 124 می باشد.
این ایزوتوپ ها هر کدام با دیگری متفاوت هستند ، زیرا علیرغم این که هر یک دارای 50 پروتون و 50 الکترون هستند ، ولی تعداد نوترون های آن ها متفاوت است و از 62 تا 74 تغییر می کند. هسته به واسطه نیرو ها ی کششی میان پروتون ها و نوترون ها نگه داشته می شود. ساز و کار اینگونه نیروهای کششی تا کنون به طور کامل درک نشده است. ولیکن جاذبه این نیروها باید آنقدر زیاد باشند تا بر دافعه نیروی الکتروستاتیک میان پروتون ها فائق آیند. اما به علت وجود همین نیروی دافعه با افزایش عدد اتمی ، نسبت تعداد نوترون به تعداد پروتون در مورد ایزوتوپ های پایدار افزایش می یابد. در میان عناصر سبک طبیعت تقریبا به ازاء هر پروتون ، یک نوترون وجود دارد.
در میان ایزوتوپ های پایدار و سنگین ، برای هر دو پروتون ، تقریبا 3 نوترون وجود دارد و همانطور که قبلا اشاره شد ، آستون دریافت که جرم های اتمی تقریبا مقادیر صحیحی هستند.
اندازه گیری های دقیق نشان می دهند که جرم کلی هسته همیشه کمتر از حاصل جمع جرم های پروتون ها و نوترون های تشکیل دهنده هسته است. در سال 1284 هخ (1905 م) اینشتن نشان داد که جرم (M) صورت دیگری از انرژی (E) است که با رابطه E=MC2 به یکدیگر مربوط می شوند و در این رابطه ، C ، سرعت نور است. این کاهش جرم هسته به وسیله مفهوم "انرژی پیوندی یا بستگی هسته ای" بیان می شود. انرژی بستگی ، مبین میزان انرژی لازم جهت شکستن هسته به نوکلئون ها ی تشکیل دهنده آن می باشد. نسبت انرژی بستگی به تعداد ذرات موجود در هسته وابسته است ، که در مورد عناصر مختلف ، متفاوت است. این نسبت در مورد عناصر با عدد جرمی میان 30 تا 120 بیشتر از عناصر بسیار سبک تر و بسیار سنگین تر پایدار است.
